Warning: Undefined array key "title" in /www/wwwroot/vitbantonquoccuong.com/wp-content/plugins/ytfind-shortcode/ytfind-shortcode.php on line 96
Việc điều chế hidro sunfua (H2S), một loại khí có mùi trứng thối đặc trưng và độc tính cao, đòi hỏi sự hiểu biết sâu sắc về các phản ứng hóa học và quy trình an toàn. Đặc biệt, câu hỏi về việc fe s hcl có mấy cách điều chế h2s là một trọng tâm quan trọng trong nghiên cứu và phòng thí nghiệm. Bài viết này sẽ đi sâu vào các phương pháp điều chế hidro sunfua, làm nổi bật vai trò của sắt sunfua (FeS) và axit clohidric (HCl), đồng thời nhấn mạnh các biện pháp an toàn hóa chất cần thiết khi xử lý loại muối sunfua này. Hiểu rõ quy trình giúp đảm bảo hiệu quả và giảm thiểu rủi ro tiềm ẩn.
Tổng Quan Về Hidro Sunfua (H2S)
Hidro sunfua, hay H2S, là một hợp chất vô cơ quan trọng nhưng đồng thời cũng cực kỳ nguy hiểm. Đây là một khí không màu, nặng hơn không khí và nổi bật với mùi trứng thối đặc trưng, dễ dàng nhận biết ngay cả ở nồng độ thấp. Khí này tồn tại rộng rãi trong tự nhiên, từ các nguồn địa nhiệt như suối nước nóng và khí núi lửa đến các môi trường sinh học như quá trình phân hủy chất hữu cơ không có oxy.Nguồn Gốc Và Tính Chất Cơ Bản Của H2S
H2S được hình thành tự nhiên thông qua sự phân hủy kỵ khí của vật chất hữu cơ, đặc biệt là protein. Quá trình này thường xảy ra ở các khu vực thiếu oxy như cống rãnh, giếng sâu, và trầm tích dưới đáy biển. Ngoài ra, khí H2S còn là sản phẩm phụ của một số hoạt động công nghiệp và cũng có mặt trong dầu thô, khí tự nhiên.
Về tính chất vật lý, H2S hóa lỏng ở -60°C và hóa rắn ở -86°C, đồng thời có khả năng tan một phần trong nước. Đây là một axit yếu, yếu hơn cả axit cacbonic, và khi tan trong nước tạo thành dung dịch axit sunfuhidric. Điểm đặc trưng nhất của H2S là tính khử mạnh, do nguyên tử lưu huỳnh (S) trong phân tử có số oxi hóa thấp nhất (-2).
Các phản ứng oxi hóa của H2S rất đa dạng. Khi tiếp xúc với oxy trong không khí, H2S sẽ bị oxi hóa tạo thành lưu huỳnh kết tủa, gây ra vẩn đục màu vàng. Ở nhiệt độ cao, H2S cháy trong không khí với ngọn lửa màu xanh nhạt, sản phẩm chính là khí lưu huỳnh đioxit (SO2) và nước. Khí SO2 có mùi hắc đặc trưng, khác hẳn với mùi trứng thối của H2S. H2S cũng có thể phản ứng mạnh với các chất oxi hóa khác như clo, tạo thành axit sunfuric.
Mức Độ Nguy Hiểm Và Biện Pháp Phòng Ngừa Khí H2S
Hidro sunfua là một chất độc mạnh, có thể gây ngộ độc nghiêm trọng hoặc tử vong ngay cả ở nồng độ thấp. Mùi trứng thối của H2S có thể giúp cảnh báo sự hiện diện của nó, nhưng khả năng gây tê liệt khứu giác nhanh chóng của khí này làm cho việc nhận biết bằng mùi trở nên không đáng tin cậy ở nồng độ cao. Ngộ độc H2S có thể gây ra các triệu chứng như đau đầu, chóng mặt, buồn nôn, và trong trường hợp nặng hơn là mất ý thức, tê liệt hô hấp và tử vong.
Theo Cơ quan Quản lý An toàn và Sức khỏe Nghề nghiệp Hoa Kỳ (OSHA), nồng độ H2S chỉ 100 ppm đã có thể gây kích thích màng phổi, và hít phải liên tục trong vài giờ có thể đe dọa tính mạng. Ở nồng độ trên 800 ppm, mất ý thức và tử vong có thể xảy ra rất nhanh chóng. Điều này khẳng định tầm quan trọng của việc áp dụng các biện pháp phòng ngừa nghiêm ngặt khi làm việc với H2S.
Các biện pháp phòng tránh bao gồm việc đảm bảo thông gió đầy đủ trong khu vực làm việc, sử dụng các thiết bị bảo hộ cá nhân chuyên dụng như mặt nạ phòng độc và quần áo bảo hộ. Khi làm việc trong không gian kín hoặc những nơi có nguy cơ tích tụ H2S cao (như giếng, bể nước), cần có người giám sát và hệ thống phát hiện khí độc liên tục. Việc tuân thủ các quy trình an toàn là yếu tố then chốt để bảo vệ sức khỏe con người và môi trường.
Nhận Biết H2S: Phân Biệt Với SO2
Việc nhận biết chính xác H2S là rất quan trọng. Mùi trứng thối là dấu hiệu đặc trưng nhất. Tuy nhiên, ở nồng độ cao, khứu giác bị tê liệt, nên cần dùng máy đo khí. Để phân biệt H2S với SO2, hai loại khí có thể gây nhầm lẫn do đều có mùi hắc, ta có thể dựa vào mùi đặc trưng (H2S mùi trứng thối, SO2 mùi diêm cháy) hoặc dùng dung dịch Ba(OH)2.
Khi SO2 tác dụng với Ba(OH)2 sẽ tạo ra kết tủa BaSO3 không tan trong nước, còn H2S tác dụng với Ba(OH)2 tạo ra BaS tan được trong nước. Phản ứng này giúp nhận biết rõ ràng hai chất khí độc này trong phòng thí nghiệm.

Fe S HCl Có Mấy Cách Điều Chế H2S: Phản Ứng Chính Trong Phòng Thí Nghiệm
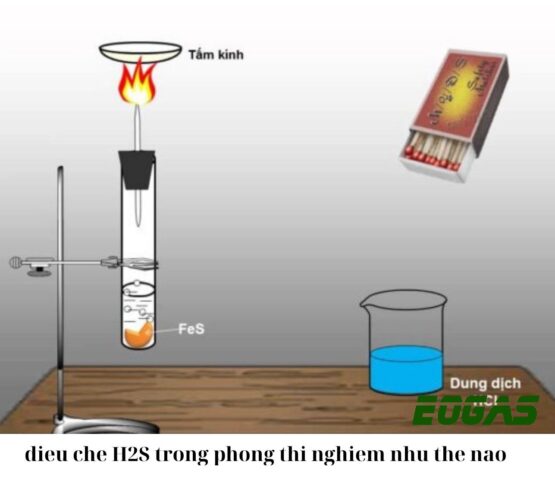
Trong môi trường phòng thí nghiệm, phương pháp phổ biến và an toàn nhất để điều chế H2S là sử dụng phản ứng giữa sắt(II) sunfua (FeS) và axit clohidric (HCl). Phản ứng này diễn ra một cách thuận lợi và kiểm soát được, cung cấp một nguồn H2S tương đối ổn định cho các thí nghiệm. Mặc dù câu hỏi “mấy cách” thường ám chỉ nhiều phương pháp khác nhau, nhưng đối với cặp chất FeS và HCl, thường chỉ có một phương pháp phản ứng chính.
Cơ Chế Phản Ứng FeS Và HCl Sản Sinh H2S
Phản ứng giữa sắt(II) sunfua và axit clohidric là một phản ứng trao đổi ion đơn giản. Sắt(II) sunfua là một muối không tan trong nước, nhưng có khả năng phản ứng với các axit mạnh để giải phóng khí H2S. Cụ thể, ion S2- từ FeS sẽ kết hợp với ion H+ từ HCl để tạo thành H2S, đồng thời ion Fe2+ kết hợp với ion Cl- tạo thành sắt(II) clorua (FeCl2) tan trong nước.
Phương trình phản ứng tổng quát là:
FeS(r) + 2HCl(dd) → FeCl2(dd) + H2S(k)
Trong phản ứng này, FeS tồn tại ở dạng rắn, thường là bột hoặc hạt nhỏ, để tăng diện tích bề mặt tiếp xúc với axit. HCl được sử dụng ở dạng dung dịch loãng hoặc vừa đủ đậm đặc để đảm bảo phản ứng diễn ra hiệu quả mà không quá mãnh liệt. Sản phẩm khí H2S sẽ được thu thập thông qua ống dẫn khí, thường được dẫn qua dung dịch hấp thụ hoặc thu trực tiếp tùy thuộc vào mục đích sử dụng.
Thiết Bị Và Quy Trình Thực Hiện Điều Chế H2S Từ FeS Và HCl
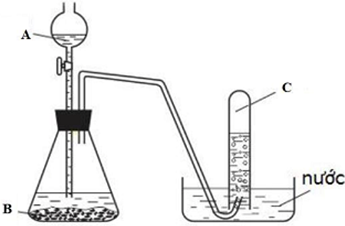
Để thực hiện phản ứng điều chế H2S từ FeS và HCl, cần có một bộ thiết bị đơn giản bao gồm:
- Bình Kipp hoặc bình điều chế khí: Thiết bị này được thiết kế để kiểm soát tốc độ phản ứng và cho phép thu hồi khí H2S một cách an toàn. Bình Kipp đặc biệt hữu ích vì nó cho phép dừng hoặc khởi động phản ứng theo nhu cầu bằng cách tách chất rắn FeS khỏi dung dịch HCl.
- Ống dẫn khí: Dùng để dẫn khí H2S sinh ra.
- Bình hấp thụ (tùy chọn): Thường chứa nước hoặc dung dịch kiềm (như NaOH, KOH loãng) để hấp thụ H2S thừa, ngăn khí độc thoát ra môi trường.
- Chất phản ứng: Sắt(II) sunfua (FeS) dạng hạt hoặc bột và dung dịch axit clohidric (HCl) loãng.
Quy trình thực hiện:
- Đầu tiên, cho một lượng FeS vào phần dưới của bình Kipp.
- Sau đó, đổ dung dịch HCl loãng vào bình từ phía trên, để axit tiếp xúc với FeS.
- Phản ứng sẽ bắt đầu ngay lập tức, giải phóng khí H2S.
- Khí H2S được dẫn qua ống dẫn và có thể được thu thập bằng phương pháp dời nước (đối với khí ít tan trong nước) hoặc bằng phương pháp đẩy không khí (úp ngược bình chứa do H2S nặng hơn không khí).
- Đảm bảo toàn bộ quá trình diễn ra trong tủ hút khí để loại bỏ khí H2S rò rỉ và bảo vệ người thực hiện thí nghiệm.
Các Yếu Tố Ảnh Hưởng Đến Hiệu Suất Điều Chế
Một số yếu tố có thể ảnh hưởng đến hiệu suất và tốc độ điều chế H2S bằng phương pháp FeS và HCl:
- Nồng độ HCl: Nồng độ axit cao hơn thường dẫn đến phản ứng nhanh hơn và hiệu suất cao hơn. Tuy nhiên, nồng độ quá cao có thể gây phản ứng quá mạnh, khó kiểm soát và nguy hiểm.
- Kích thước hạt FeS: FeS dạng bột mịn có diện tích bề mặt lớn hơn, cho phép phản ứng nhanh hơn so với FeS dạng hạt lớn.
- Nhiệt độ: Tăng nhiệt độ có thể đẩy nhanh tốc độ phản ứng, nhưng cần kiểm soát chặt chẽ để tránh phản ứng ngoài tầm kiểm soát và nguy cơ an toàn.
- Độ tinh khiết của FeS: Tạp chất trong FeS có thể ảnh hưởng đến tốc độ và độ tinh khiết của khí H2S thu được.
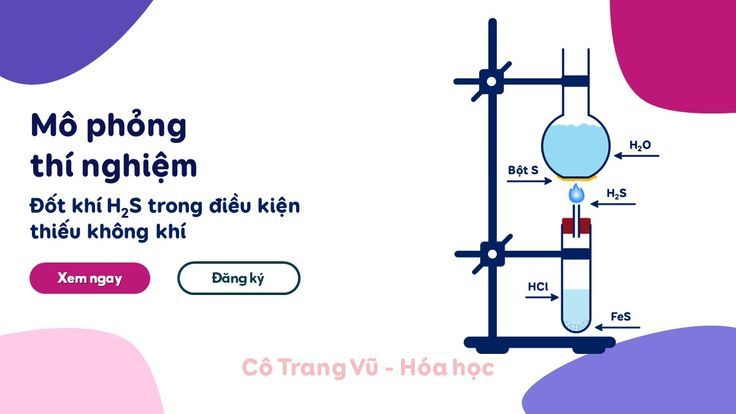
Các Phương Pháp Điều Chế H2S Khác Trong Hóa Học
Ngoài phương pháp FeS và HCl phổ biến trong phòng thí nghiệm, có một số phương pháp khác để điều chế H2S, bao gồm cả các phản ứng trong phòng thí nghiệm và quy trình công nghiệp. Việc tìm hiểu các phương pháp này giúp ta có cái nhìn toàn diện hơn về cách thức sản xuất và nguồn gốc của khí H2S.
Điều Chế H2S Từ Hidro Và Lưu Huỳnh
Một phương pháp điều chế H2S trực tiếp hơn, mặc dù ít được sử dụng trong phòng thí nghiệm phổ thông do yêu cầu nhiệt độ cao, là cho khí hidro (H2) phản ứng trực tiếp với lưu huỳnh (S) ở nhiệt độ cao.
Phương trình phản ứng:
H2(k) + S(r) → H2S(k) (xúc tác nhiệt độ)
Quy trình này thường liên quan đến việc dẫn một luồng khí hidro qua bột lưu huỳnh đang được đun nóng trong một ống nghiệm hoặc lò nung. Lưu huỳnh sẽ nóng chảy và phản ứng với hidro để tạo thành H2S. Phản ứng này yêu cầu nhiệt độ cao để phá vỡ liên kết trong phân tử S8 (dạng tồn tại phổ biến của lưu huỳnh) và tạo điều kiện cho phản ứng với hidro. Cần chú ý thu gom khí H2S sinh ra để tránh gây độc hại.
Điều Chế H2S Từ Các Muối Sunfua Khác
Bên cạnh FeS, các muối sunfua của nhiều kim loại khác cũng có thể phản ứng với axit mạnh để tạo ra H2S. Các muối sunfua được chia thành nhiều loại dựa trên tính chất hóa học và khả năng tan trong nước hoặc axit.
- Muối sunfua của kim loại kiềm và kiềm thổ (trừ Be): Ví dụ như Na2S, K2S, BaS. Những muối này tan trong nước và phản ứng dễ dàng với HCl loãng.
Na2S(dd) + 2HCl(dd) → 2NaCl(dd) + H2S(k)
Phản ứng này tạo ra H2S rất nhanh và mạnh, đôi khi khó kiểm soát hơn so với FeS do Na2S dễ tan trong nước. - Muối sunfua không tan trong nước nhưng tan trong axit: Ví dụ như ZnS. Tương tự FeS, ZnS cũng phản ứng với axit mạnh như H2SO4 loãng để tạo ra H2S.
ZnS(r) + H2SO4(dd) → ZnSO4(dd) + H2S(k) - Muối sunfua không tan trong nước và không tan trong axit loãng: Ví dụ như CuS, PbS, Ag2S. Các muối này không phản ứng với HCl hoặc H2SO4 loãng. Để điều chế H2S từ các muối này, cần sử dụng các axit mạnh hơn hoặc các điều kiện phản ứng đặc biệt hơn. Ví dụ, CuS không phản ứng với HCl, nhưng có thể được điều chế H2S thông qua các phản ứng gián tiếp hoặc trong các quy trình công nghiệp phức tạp hơn.
Trong công nghiệp, H2S có thể được sản xuất thông qua nhiều quy trình khác nhau, thường là sản phẩm phụ của quá trình lọc dầu hoặc chế biến khí tự nhiên. H2S cũng có thể được tổng hợp từ hydrocacbon và lưu huỳnh ở nhiệt độ cao.
Ứng Dụng Thực Tiễn Của H2S Và Tầm Quan Trọng Của Việc Điều Chế
Mặc dù là một chất khí độc hại, H2S vẫn có nhiều ứng dụng quan trọng trong các ngành công nghiệp và nghiên cứu khoa học. Sự độc đáo trong tính chất hóa học của nó, đặc biệt là tính khử mạnh và khả năng tạo muối sunfua, làm cho việc điều chế và kiểm soát H2S trở nên cần thiết.
Vai Trò Của H2S Trong Công Nghiệp Và Nghiên Cứu
H2S đóng vai trò quan trọng trong nhiều lĩnh vực:
- Sản xuất axit sunfuric và lưu huỳnh: H2S là một nguyên liệu thô quan trọng trong quá trình Claus để thu hồi lưu huỳnh elemental và sản xuất axit sunfuric. Quá trình này giúp giảm thiểu ô nhiễm từ khí H2S thải ra.
- Hóa chất trung gian: H2S được sử dụng để sản xuất các chất sunfua vô cơ khác, là nguyên liệu cho nhiều ngành công nghiệp như thuốc nhuộm, thuốc trừ sâu, dược phẩm, và chất phụ gia cao su.
- Sản xuất nước nặng: Trong ngành công nghiệp hạt nhân, H2S được sử dụng trong quá trình Girdler Sulfide để sản xuất nước nặng (D2O), cần thiết cho lò phản ứng hạt nhân.
- Phân tích hóa học: Trong hóa phân tích, H2S được dùng làm thuốc thử để kết tủa các ion kim loại nặng dưới dạng sunfua, giúp tách và nhận biết các nguyên tố.
- Công nghiệp gia công kim loại: H2S có mặt trong một số loại dầu cắt, chất làm mát và chất bôi trơn, đóng vai trò trong việc cải thiện tính năng gia công hoặc bảo vệ bề mặt kim loại.
- Y sinh và sinh học: Ở nồng độ rất thấp, H2S được phát hiện là một phân tử tín hiệu trong cơ thể, đóng vai trò trong nhiều quá trình sinh lý như điều hòa huyết áp và chức năng thần kinh.
Quản Lý Và Xử Lý H2S An Toàn Trong Sản Xuất
Do tính độc hại cao của H2S, việc quản lý và xử lý an toàn trong các ứng dụng công nghiệp là vô cùng cấp thiết. Các hệ thống điều chế và sử dụng H2S phải được thiết kế kín, có hệ thống thông gió hiệu quả và các thiết bị phát hiện rò rỉ khí.
Các quy trình xử lý bao gồm việc hấp thụ H2S thừa bằng các dung dịch kiềm hoặc các chất hấp phụ đặc biệt trước khi thải ra môi trường. Đào tạo nhân viên về các mối nguy hiểm của H2S và các biện pháp ứng phó khẩn cấp là bắt buộc. Việc tuân thủ nghiêm ngặt các tiêu chuẩn an toàn lao động và môi trường là yếu tố then chốt để khai thác lợi ích của H2S mà vẫn bảo vệ được sức khỏe con người và hệ sinh thái.
Điều này không chỉ áp dụng cho các nhà máy hóa chất mà còn cho các cơ sở nghiên cứu và bất kỳ nơi nào có khả năng tạo ra H2S. Cơ khí Quốc Cường, với kinh nghiệm lâu năm trong gia công cơ khí, hiểu rõ tầm quan trọng của vật liệu và quy trình an toàn trong sản xuất. Mặc dù không trực tiếp điều chế H2S, việc nắm vững thông tin về các phản ứng hóa học cơ bản giúp tạo ra các sản phẩm chất lượng cao và an toàn cho nhiều ngành công nghiệp. Công ty luôn cải tiến kỹ thuật, nâng cao kỹ năng đội ngũ 150 nhân viên lành nghề để đáp ứng yêu cầu khắt khe của khách hàng và đối tác quốc tế.
Tóm lại, việc hiểu rõ các phương pháp điều chế H2S, đặc biệt là phản ứng giữa FeS và HCl, cùng với các yếu tố ảnh hưởng và biện pháp an toàn, là nền tảng quan trọng trong hóa học. Từ tính chất vật lý, hóa học, đến mức độ nguy hiểm và các ứng dụng thực tiễn, hidro sunfua đòi hỏi sự thận trọng và chuyên môn cao trong xử lý. Nắm vững kiến thức này không chỉ giúp các nhà khoa học và kỹ thuật viên thực hiện công việc hiệu quả mà còn đảm bảo an toàn tối đa, góp phần vào sự phát triển bền vững của nhiều ngành công nghiệp.
Ngày Cập Nhật Mới Nhất: Tháng 10 25, 2025 by Cơ khí Quốc Cường

Chuyên gia cơ khí chính xác tại Cơ khí Quốc Cường – là một trong những công ty hàng đầu Việt Nam chuyên sâu về sản xuất, gia công cơ khí.
